
Para conocer las fuerzas de enlace se van aplicar modelos o formas de entenderlo:
a) Enlace iónico. Se da cuando los dos elementos que intervienen poseen una electronegatividad muy distinta, o sustancias que contienen iones. La naturaleza es electrostática.
Por ejemplo, en Na+ Cl-, la electronegatividad del Na es muy diferente a la del Cl. El Cl toma totalmente el e- del Na:
| XC1 >> XNm | Cl + e- | ---------------------> | Cl- | |
| Na | ---------------------> | Na+ + e- |
Enlace matálico. Se produce entre átomos de carácter metálico. El hecho de que sean conductores se debe a que existe un deslocalización de los e-, pudiéndose mover en a estructura.
Enlace covalente. La carácterística más importante de este tipo de enlace es la compartición de los e-. Un ejemplo típico es el HCL. Este compuesto, lo forman elementos con electronegatividad muy parecida, existiendo una compartición de e- entre el H y el Cl, sin embargo, en este caso, la electronegatividad del Cl es algo mayor que la del H, por lo que estará más desplazado hacia el Cl. Esto se representa por:
| H ---------> Cl ó Hσ+ Clσ- |
Como ya se ha mencionado, se forma por la compartición de los e-, y ocurre siempre que:
+-------+ +-------+ +--\/--+
A | · | | · | B -------> A | # | B
+-------+ +-------+ +--/\--+
y se representa por: A:B ó A - B.
El número de enlaces depende del número de e- desapareados en orbitales estables. Por ejmplo: B (2s2 2p1), sólo posee un e- desapareado, y está en estado fundamental, aunque se puede hacer pasar un e- del s2:
| 2s 2p1+1 -↑-↓- -↑--- ---- --------> -↑--- -↑--- -↑--- ---- |
como se observa forma tres enlaces en estado excitado BH3.
· El Carbono (C = 2s2 2p2): 2s1 2p1+1+1 en este estado excitado puede formar 4 enlaces: CH4.
· El Nitrogeno (N = 2s2 2p3): se pueden formar 3 enlaces: NH3.
· El Oxígeno (O = 2s2 2p4): se pueden formar 2 enlaces: OH3.
· El Flúor (F = 2s2 2p5): forma 1 enlace: FH.
· El Fósforo (P = 3s2 3p3 3d0): en estado excitado su configuración es 3s1 3p3 3d1, por lo tanto podrá formar 3 y 5 enlaces.
· Al O y al S, les ocurre lo mismo que en el caso anterior.
Los cabeza de grupo, sólo poseen s y p, por lo que tendrán un comportamiento distinto a los del resto del grupo con s, p y d.
Para que un enlace covalente sea estable, es necesario:
1. Los dos orbitales tengan energías parecidas. ΨA ≈ ΨB
Las funciones de onda tengan el mismo signo matemático [SGN(ΨA = ΨB)]. Si:
| ΨA |
+---+ +---+ +--+-+--+
A | +| |+ | ------------> A |##|#|##| B
+---+ +---+ +--+-+--+
+---+ +---+
A | +| |- | ------------> No hay enlace
+---+ +---+
En las energías:
^ Orbital enlazante
| (b) <----------+
| -----
| / \
| / \
| ^ (a)/ \ (c)
HF | -+---- ------+
| H \ / F v
| \ /
| \^(b) /
| +---+
| v
|
(a) ΨA; (b) ΨAB; ΨB
Para que se puedan solapar compartiendo e-, sus energías deben ser parecidas, o bien, que su electronegatividad sea semejante.
- Cuando se combinan dos orbitales atómicos se producen orbitales moleculares, unos de mayor energía (el más inestable), y otro de menor energía (más estable).
- El enlace covalente formado produce una molécula más estable.
- La energía que pone en juego cuando se unen A y B en estado neutro, se conoce como 'energía de enlace'.
| A(g) + B(g) <------------> A - B (g) |
- A la energía necesaria para romper un enlace se llama 'energía de disociación'.
- El enlace covalente es más estable cuanto más parecida es la energía de los elementos.
- Radio covalente de un elemento. Si se conocen los radios atómicos de los elementos y se miden después de la unión, la distancia internuclear será rA+rB.
La estabilidad será mayor, cuanto menor sea el radio atómico, y por tanto mayor será fuerza de enlace. Entonces el radio atómico de un elemento, es la distancia internuclear una vez estén solapados.
|
+--------------+++----------+
| R(a) ||| R(b) |
A | ·-------+++-----· | B
| ||| |
+--------------+++----------+
|
- Cuanto más alta es la energía de enlace, mayor es la estabilidad.
- Se conoce como orbital 'antienlazante', al orbital de nivel energético más alto que se forma. Se forman tantos antienlazantes, como número de orbitales posea:
Orbital enlazante
(b) <----------+
-----
/ \
/ \
^ (a)/ \ (c)
-+---- ------+
\ / v
\ /
\^(b) /
+---+ <--- Nivel enlazante
v más bajo. Enlazante.
(a) ΨA; (b) ΨAB; ΨB. ΨAB = aΨA + bΨB da el número de orbitales.
La energía de disociación está relacionada con ΨAB, por lo tanto la energía de enlace da la fuerza de enlace.
- Cuando dos átomos A y B, se solapan o forman enlace covalente tienden a solaparse lo máximo posible, de forma que la energía liberada sea mayor, así como su estabilidad.
El solapamiento también se relaciona con el radio atómico, es decir, menor es dAB, por tanto, el enlace es más estable. Por medio de 'Difracción de Rayos X', se pude conocer la distancia intenuclear (dAB).
La 'hibridación de orbitales' es una forma de alcanzar la máxima estabilidad. Para que tenga lugar, a veces, se combinan sus orbitales atómicos. Ejemplo: CH4:
| 2s2 2p2 = -↑↓- -↑-- -↑-- ---- |
Puede desaparear:
| -↑-- | -↑-- | -↑-- | -↑-- | 4sp3 | |
| s | p | ||||
| H: | 1s1 | 1s1px | 1s1py | 1s1pz |
En el átomo de C la Ψs y las tres funciones del Ψp, se combinan (geométricamente):
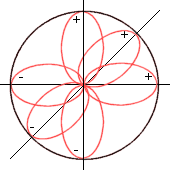
la suma daría (geométricamente):

se forman 4sp3 (orbitales híbridos ocupan los vértices de un tetraedro):
| H |
|
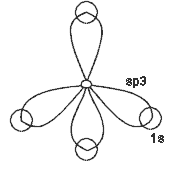
|
Esta teoría de pone de manifiesto por la forma geométrica molecular de los compuestos formados. Por otro lado, si no fuera un tetraedro, los orbitales se situarían en los ejes de coordenadas.
Geometrías al hibridarse:
· Si se combina un orbital 1s y 1p, el resultado gemoétrico es lineal: B -- A -- B (α = 180°).
· Si se hibrida 1s y 2p, dará tres orbitales híbridos 3sp2, con geometría triangular plana (α = 120°):
(b)
-----
/ \
+----------+ +------+ / \
| | | ^ | ^ (a)/ \ (c)^
A | | | || | B -+---- -----++
| | | v | \ / v
+----------+ +------+ \ /
\^(b) /
+---+
v
(a) ΨA; (b) Ψ*AB; c) ΨB.
· A estos orbitales formados por solapamiento frontal de dos orbitales, se les conoce como enlace de 'tipo σ':
+---+ +------+ +---+ +---+ +---+ +---+ +---+
| - |A| + |B| - | | - |A| + | | + |B| - |
---+---+o+------+o+---+-----> +---+o+---+--------+---+o+---+->Z
| | | | | | | | | | | | | |
+---+ +------+ +---+ +---+ +---+ +---+ +---+
· Enlace de 'tipo π':
^ X | | +---+ | +---+ +---+ / + \ | | + | | + | / \ | \ / \ / +--------+ +-----o---------o----> Z ----o--------o-----------> Z | / \ / \ A +--------+ B | | - |A | + |B \ - / | +---+ +---+ \ / | +--+
· Enlace de 'tipo δ':
| (dx2y2)A |
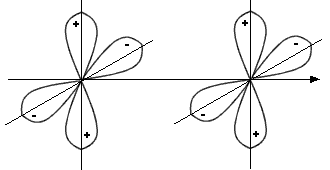 |
El enlace iónico se determina por el tamaño de los iones, es decir, es direccional:
| Na+ Cl- | 6 Octaedro |
| Ca+ Cl- | 8 Cubo |
En el enlace covalente la geometría viene determinada por el carácter direccional de los orbitales atómicos. Para explicar esto, se aplica la teoría de la 'hibridación de orbitales' (combinaciones lineales de orbitales atómicos):
| +-----------> | sp ---------- | lineales. | |
| +-----------> | sp2 --------- | triangulares. | |
| Hibridación | +-----------> | sp3 --------- | tetraédricos. |
| +-----------> | sp3 d2 ------ | octaédricos. |
Para los niveles cuánticos:
| N=2 | sólo | 2s 2p |
| N=3 | sólo | 3s 3p 3d |
Ejemplos:
| sp | AX2 | BeCl3 |
| sp2 | AX3 | BCl3 |
| sp3 | AX4 | SiCl4 |
| AX3 | NH3 | |
| AX2 | H2O | |
| sp3 d2 | AX6 | SF6 |
| AX6 | IF6 |
| BeCl3 2s2 |
2s1 2p1 -------------> (sp1) (sp1) => Cl -- Be -- Cl. Lineal
| BeCl3 2s2p1 |
| 2s1 2p1+1 ---------> (sp2)1 (sp2)1 (sp2)1 (sp2)1 => |
|
| SiCl4 2s2 2p2 |
| 2s1 2p1+1+1 ---------> (sp3)1 (sp3)1 (sp3)1 (sp3)1 => |
|
||||||||||||||||||||||||||||||
|
|
| 2s2 2p3 ---------> (sp3)2 (sp3)1 (sp3)1 (sp3)1 => |
¨ _
N / \
/ | \ |· ·|
H H H N
/ \
/·/|·|\·\
|_/ \_/ \_|
Si se tienen cuatro pares de enlaces se encuentran sometidos a un par de núcleos. Contrariamente, si se tienen no enlazantes, sólo se halla sometido a un núcleo, siendo la repulsión mayor por parte de los dos e-. Su geometría no define un tetraedro exacto, sino que cierra un poco más sus ángulos.
Estos no enlazantes, podrían formar 'enlaces dativos', es decir, con otro átomo que no tuviera nigún e- en su orbital.
Si a la molécula de NH3, se le hace reaccionar con una molécula que aporte protones, se obtiene un 'enlace dativo':
\ |\ |+
\ +---------+-+----+ | \ |
-- N | · · | | | -----------> |-- N -|
/ +---------+-+----+ | / |
/ Covalente dativo |/ |
La molécula de H2O dará cuatro híbridos sp3.
|
|
|
|
|
|
(b)
------
/ \
/ \
- --+-+-- - ^(a)/ \(a)^
| F | | F | -+--- ---+-
- --+-+-- - \ /
\ /
\ ^ /
--+--+-
v (b)
| (a) = ΨF |
| (b) = σ(F2) |
El orden de enlace (los pares de e- que unen dos núcleos) en la molécula de Flúor es 1.
|
|
| s | s -----------------> | Orbital σ | |
| pz | pz ----------------> | Orbital σ | :N≡N: |
| px py | px py ------------> | Orbital π |
+-----------------------+
| + (a) |
+-----------------------+
+----------+|+--------+-+--------+|+-----------+
| +----| |---+####|#|####+---| | +-----|
----| : +| - +N+#-#|##+#|#|#+##|#-#+N+ - |+ : | ----> Z
| +----| |---+####|#|####+---| | +-----|
+----------+|+--------+-+--------+|+-----------+
+-----------------------+
| (b) |
+-----------------------+
| Forma un híbrido. | (a) πx,y (b) σN-N |
|
|
| + | ----------- | + | ||||
| Cδ+ | | | | | Oδ- | |||
| + | ----------- | + |
Siempre que se tengan dos átomos distintos A y B, se producirá un enlace polar si XB > XA (X = electronegatividad). Se representa por:
| Aδ+ ------------ Bδ- |
Cuando se produce el enlace polar, el par de electrones compartidos tiende a estar más cerca del núcleo del átomo, que es más electronegativo, creándose entonces un dipolo -por física, se sabe que un dipolo consta de dos cargas iguales, una positiva y otra negativa, situadas a una distancia d. La magnitud que define a un dipolo es el momento dipolar, μ = q · d (C·m)- ya que las cargas negativas están desplazadas hacia un lado del enlace y las psositivas hacia el otro.
|
|
Relación de la electronegatividad con la polaridad:
| ^ | |||
| | | F - H | más polar | |
| Electronegatividad | | | Cl - H | |
| | | Br - H | ||
| | | I - H | más covalente |
- Distancia internuclear:
Cuando el enlace es covalente, determina la fuerza del enlace:
| N - N d(N - N) = 1.09 Å |
en estos casos se usa el radio covalente en vez de la distancia internuclear, que es:
| d(N - N) | ||
| (rcov)N = | ------------------ | |
| 2 |
| orden | d(N - N) | rcov | ||||
|---|---|---|---|---|---|---|
| N - N | 1 | ^ | ^ | |||
| N = N | 2 | | | | | |||
| N ≡ N | 3 | | | | |
De esto se deduce que la distancia internuclear, aumenta con el orden de enlace. Por ejemplo, el radio del N es 0.74 Å en el caso del enlace sencillo, cuando el enlace es doble, es 0.62 Å y en el triple 0.55 Å.
© Mario Izquierdo, 2024 | Aviso legal | Política de Privacidad