
Características generales de los haluros:
Constituyen un grupo en el que aparecen una serie de compuestos, formados por iones halógenos monovalentes electronegativos, F-, Cl-, Br-, I-, que son grandes, teniendo una carga de sólo -1, con facilidad para polarizarse. De estos compuestos existen 90 especies bien caracterizadas que pertenecen a:
• Además de estos cationes, también existe otra serie de haluros con metales de base como Cu, Zn, Fe y Pb.
• El F es el elemento más abundante en rocas ígneas: F (600 ppm) > Cl (314 ppm) > Br (1,62 ppm) > I (0.3 ppm). El radio del F es aproximadamente 1.32, muy semejante al del O y al del (OH-), lo que permite que existan sustituciones entre ellos.
• Se concentra en los últimos estadios de la cristalización magmática de pegmatitas, en yacimientos Sn-W y yacimientos hidrotermales, formando Topacio, Fluorita, Ambligonita (fosfato de Li, típico de pegmatitas), Silicofluoruros, Aluminofluoros, Borofluoruros y fluoruros de Tierras Raras (T.R.); Fluorita.
• A diferencia del F, el Cl no entra a formar silicatos debido a que su radio iónico es mucho mayor, así como por su solubilidad que impide la entrada en rocas ígneas. Aparece asociado a un origen fumarólico, formando cloruros de Fe, Mn, Al y Mg. El Cl es un componente importante en fluidos, ya que sirve para el transporte de iones, siendo frecuente en inclusiones fluidas.
• En condiciones exógenas el F es inmóvil, contrariamente al Cl que es muy soluble. Como consecuencia, parte va a parar a aguas marinas y parte a las continentales (forma ClNa, Mg y Ca).
• El Br y el I no se concentran en condiciones magmáticas, ni tampoco forman minerales propios. En condiciones exógenas (en el mar) el Br es más abundante que el I y el F. En la atmósfera el más abundante es el I (vapor de I).
• Desde el punto de vista cristaloquímico, dentro de esta clase se pueden encontrar mas cloruros que fluoruros: 50% de cloruros, 25% de fluoruros y el resto serían bromuros y ioduros.
• Los fluoruros y cloruros por regla general son monocatiónicos, pudiendo presentar a veces dos cationes, asociándose uno grande con uno pequeño: K-Na, K-Mg, K-Ca, Pb-Cu. Los que son monocatiónicos poseen mayor simetría y son compuestos con fórmula tipo AX ó AX2. Ejemplo:
AX ------------ NaCl
AX2 ------------ F2Cl
Los que tienen dos cationes tienen simetría menor, existiendo mayor participación de enlace covalente.
• La dureza en los fluoruros es mayor que la de los cloruros, Bromuros y Ioduros. Para el MgF (Selaita) oscila entre 5 y 1.
• La densidad varía entre 1 y 9. Los mas densos son los cloruros, y dentro de estos existe una variación dependiendo del tipo de catión. La densidad en los fluoruros es de 3-4.
• El índice de refracción (I.R.) en los cloruros es mayor que en los fluoruros.
Clasificación de los haluros:
| │ | Grupo de la Fluorita | |
| A) Fluoruros | │ | Grupo de la Avogadrita |
| │ | Grupo de la Criolita |
B) Cloruros, Bromuros y Ioduros:
| - Asociación Al-Mg-Fe | │ | Grupo de la Laurencita |
| │ | Grupo de la Keuperita | |
| - Asociación Na-Ca-K | │ | Grupo de la Halita |
| │ | Grupo de la Carnalita | |
| │ | Nantokita-Querargita | |
| │ | Atacamita | |
| - Asociación Ca-Pb-Hg | │ | Grupo de la Boleíta |
| │ | Grupo de la Colomelana |
Dentro de este grupo se incluyen los siguientes minerales:
| - Fluorita ------- | F2Ca | |
| - Selaita ------- | F2Mg | |
| - Villiaumita --- | NaF |
• FLUORITA.- Cristaliza en el sistema cúbico. Su estructura, se puede explicar de dos formas:
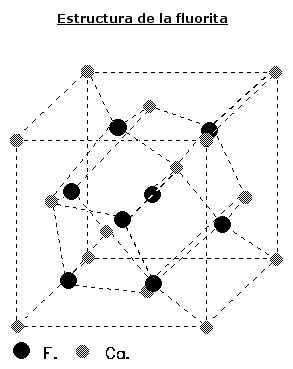
En la Fluorita pueden existir sustituciones de Ca por T.R., concretamente por Itrio (Itriofluorita) y Cerio (Ceriofluorita).
Presenta hábito cúbico y octaédrico. Con frecuencia cubos maclados según [111] en forma de maclas de penetración. Generalmente en cristales o masa exfoliables. También macizo; granular grueso o fino; columnar.
Posee una exfoliación octaédrica perfecta según {111}. Es transparente a translúcido. Brillo vítreo. El color varía bastante, siendo normalmente verde claro, amarillo, verde azulado o púrpura; también incoloro, blanco, rosa, azul, castaño. El color en algunas Fluoritas es consecuencia de la presencia de hidrocarburos. El I.R. es bajo, 1.433. Es fluorescente y fosforescente.
YACIMIENTOS:
• Como mineral accesorio menor en diversas rocas graníticas y pegmatitas.
• Es un componente importante en carbonatitas. En Pagora aparece asociado Apatito, U y T.R.
• En yacimientos Sn-W, con Scheelita:
- En yacimientos hidrotermales, en los que puede ser mineral principal o aparecer como ganga junto a menas metálicas, sobre todo Pb y Ag. En Asturias e Illinois, la Fluorita que no forma cristales, se encuentra en las calizas formando filones.
• En yacimientos estratiformes sedimentarios en medio lagunar o marino, tipo Mexicano.
- EMPLEO:
• Se usa como fundente en la fabricación de acero.
• En la fabricación de ácido fluorhídrico (FH).
• La variedad óptica se emplea en pequeñas cantidades en la fabricación de prismas y diversos sistemas ópticos.
· ASOCIACION Na-Ca-K
En cuanto al comportamiento geoquímico, el radio del K es similar al del Rb y Cs, por ello pueden darse sustituciones de K por Rb o Cs. Entre el Na y el K existe una gran diferencia de radios lo que supone que no puedan existir sustituciones isomórficas entre Na y K.
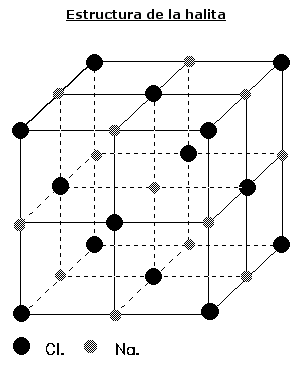
• HALITA.- Es el más importante. En su estructura cada catión y cada anión está rodeado por 6 vecinos más próximos en coordinación octaédrica. La estructura de la Halita fue la primera que se determinó mediante técnicas de difracción de rayos X por W.H. y W.L. Bragg en 1913.
Tiene una dureza de 2.5, dureza superior a la de la Silvina. La Silvina debe su color rojizo a la existencia de inclusiones de Hematites. Se diferencia de la Halita, como ya se ha dicho, por su dureza, que es menor, así como su densidad; otra característica que las diferencia es el sabor, la Silvina tiene un sabor salado pero más amargo que la Halita.
Presenta hábito cúbico. Su exfoliación es perfecta según (110), mientras que la Fluorita posee exfoliación según (111). Esto se debe a la menor fuerza de atracción que existe, en la Fluorita, entre los átomos según (111), siendo estas fuerzas mayores en la Halita.
Presenta color blanco o incolora, aunque puede tener tonalidades amarillas, rojas, azuladas y púrpura en ejemplares impuros. Su sabor, como ya se ha mencionado, es salado.
YACIMIENTOS:
• Es de origen sedimentario. Los depósitos de sal se han originado por la evaporación gradual y desecación final de masas de agua salada. Para que se produzca es necesario que las aguas tengan alta concentración de sal, ya que esta es muy soluble. También aparece disuelto en aguas de manantiales y lagos salados.
• Aparece también en el Keuper (Triásico).
• En domos de sal. El domo de sal es una masa casi vertical, que penetra en las rocas hacia la superficie desde una capa profunda. Normalmente en estos casos suele aparecer asociada a petróleo.
La explotación puede ser:
• SILVINA.- Es el cloruro de potasio (KCl), siendo isotípico con la Halita, pero no existen sustituciones isomórficas entre Na y K.
Cristaliza en el sistema cúbico. Es transparente si es puro. Incoloro o blanco; también con tonalidades azuladas, amarillentas o rojizas (con Fe), debido a las impurezas.
Su dureza es de 2, inferior a la de la Halita. Su densidad también es menor. Presenta sabor amargo picante.
YACIMIENTOS:
• Su origen es fundamentalmente evaporítico, como los yesos.
• Tiene el mismo origen, forma de yacimiento y paragénesis que la Halita, pero es mucho menos frecuente.
España es un importante productor de sales potásicas. Aparece en Barcelona y Lérida, siendo las mineralizaciones del Eoceno, no se encuentran plegados y se utiliza en una minería tradicional (Suria y Cardona)
EMPLEO:
• Es la principal fuente de los compuestos de K, que se utilizan como fertilizantes.
• Un 5% para jabón.
• Elaboración de vidrios.
• CARNALITA.- Su fórmula es CaMg. Se encuentra asociado a la Silvina. Su dureza es inferior a la de la Halita 1 - 2.5.
En ella, parte del Mg2+ se encuentra sustituido por Fe+2. Su sabor es amargo.
Se forma en cuencas lacustres, asociada a la Halita y a la Silvina.
· ASOCIACION Cu-Pb-Hg
GRUPO DE LA NANTOKITA-QUERARGIRITA:
Existe una serie de cristales mixtos: con Ag y Cu está la serie de la Querargirita-Nantokita.
• QUERARGIRITA-BROMARGIRITA.- Poseen estructura tipo NaCl, desde la Querargirita hasta la Bromargirita forman una serie isomorfa completa, los cristales mixtos se denominan embolitas.
Son incoloras o amarillentos debido a la Ag. Se encuentran en la zona de oxidación en yacimientos de Ag (Hiendelaenciana).
La Iodargirita se engloba en esta serie, cristalizando en el sistema hexagonal al igual que la Miargirita (AgI y CuI respectivamente). Por cada 5 átomos existe uno de Cu en la Miargirita.
| • El Ioduro de Cu, es la Barshita. | │ | Son isoes- |
| │ | tructurales | |
| • Nantokita | │ | con la Sph. |
GRUPO DE LA ATACAMITA:
Es un cloruro de Cu, más o menos hidratado. En general en todos los sulfatos cristalizan en el sistema rómbico. Poseen colores verdes vistosos. Los cristales son prismáticos como en el desierto de Atacama. Aparecen en la zona de oxidación de los pórfidos de Cu.
GRUPO DE LAS BOLEITAS:
• Son cloruros con Pb9Cu8Ag3Cl21(OH)16× 2H2O.
• Color azul intenso.
• Se forman en la zona de oxidación-cementación de Cu y Pb.
© Mario Izquierdo, 2024 | Aviso legal | Política de Privacidad