
Se encuentran bien caracterizados 250 minerales. No se encuentran compuestos en los que el elemento metálico aparezca unido al S, o bien al As (Se, Te). También, pero menos frecuente, Sb y Bi.
De todos los elementos de su grupo (Se, As y Bi), el S es el más abundante con 520 gr/T:
El S2- actúa como anión en los sulfuros, mientras que el S6+ actúa dentro del grupo de los sulfatos (SO-).
La oxidación gradual del S es:
S2- --> S- --> S° --> S4+ --> S6+El Se da selenitos:
- S° ----- 1.04.* Grupos:
* Características:
| Fórmula de los sulfuros | Fórmula de las sulfosales |
| A X | A B S2 |
| A2 X | A2 B S3 |
| A3 X | A3 B S3 |
| A X2 | A3 B S4 |
| A B2 | S4 |
| Ind. Emp. | Dureza | |
| S2 Fe ──────── Pirita | 9.5 | 6.5 |
| (Fe Ni)9 ───── Pentladita | 7.8 | 4.0 |
| Cu5 Fe S4 ───── Bornita | 6.6 | 3.0 |
| S Pb ────────── Galena | 6.0 | 2.5 |
| Ind. Emp. | Dureza | Densidad | Reflect. | |
| Pb Te ─ Altaita | 7.3 | 3.0 | 8.2 | 63.2 |
| Pb Se ─ Claustalita | 6.7 | 2.7 | 7.8 | 50.4 |
| Pb S ── Galena | 6.0 | 2.5& | 7.5 | 42.4 |
Los sulfuros sedimentarios se dan en cuencas con condiciones muy reductoras, pero la mayoría de los sulfuros se forman en condiciones endógenas, la mayor parte en los primeros estadios del magmatismo, durante la segregación magmática, en condiciones de inmiscibilidad química. Aunque la mayoría lo hacen en condiciones hidrotermales. Explicar este hecho es muy difícil, ya que los metales son muy insolubles incluso a temperaturas muy elevadas, entonces, habría que reunir grandes masas de agua. La forma de explicar este contenido en metales sería que estos:
a) Transporte en forma de volátiles:
Se utiliza para explicar la formación de sulfuros a temperaturas elevadas como haluros y cloruros. Este tipo de transporte es válido para determinados sulfuros, sólo a altas temperaturas.
b) Transporte en forma coloidal:
Generalmente, este tipo de transporte sólo es válido a bajas temperaturas.
c) Transporte en forma de disolución:
En iones simples, explicar el transporte a bajas temperaturas es muy difícil. La secuencia es:
| Mn>Fe>Co>Ni>Cu>Zn>Cd>Bi>Pb>Ag>Hg | ||
| + soluble | - soluble | |
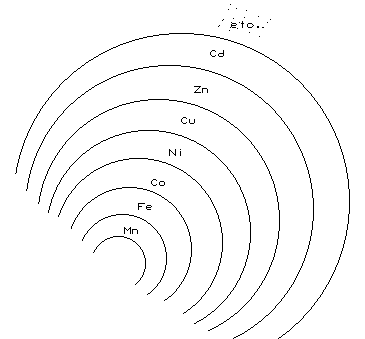
El transporte en forma de iones simples resulta imposible. El transporte se realiza en forma de iones complejos, en forma de complejos de Cl y S.
Los complejos de Cl se pueden explicar a temperaturas mayores y los polisulfurados en un intervalo de temperatura más amplio. Se puede explicar el transporte de iones complejos de S a bajas y a altas temperaturas, para ello el pH debe ser alcalino.
Existen 2 ventajas fundamentales en el transporte de iones complejos: la solubilidad y que la distribución teórica zonal coincide con la observada en la naturaleza.
a) Químicas, en la que la clasificación se hace en función del radio del metal al de S. Esta clasificación es artificiosa.
b) Clasificación de Kostov, basada en la paragénesis mineral.
b) Clasificación de Kostov:
Se establecen tres grupos:
Se encuentran relacionados genéticamente con los de Ni-Co-Fe.
Dentro de la asociación Pt-Pd-Ru aparecen bien caracterizados 10 sulfuros, pero los más frecuentes son 4:
| Mineral | Fórmula | Sistema crist. | Dureza | Densidad |
| Cooperita | S Pt | Tetragonal | 4.5 | 9.5 |
| Braggita | S(Pt,Pd) | Tetragonal | - | 10.0 |
| Esperrilita | PtAs2 | Cúbico | 6-7 | 10.5 |
| Laurita | S2R | Cúbico | - | - |
La Esperrilita es el mineral más frecuente, teniendo un contenido en Pt del 36%. Es importante desde el punto de vista de la exploración, analizando también Ro, Cu y Fe.
Si aparece cristalizada, es en cubos, con una estructura parecida a la de la Pirita. Es de color blanco metálico y muy densa.
Los principales yacimientos son de segregación magmática y dentro de estos en dos tipos:
Aparecen unos 50 minerales conocidos, entre los que están también Cu, Mn ó Ca, y los aniones son:
más raramente el As, Sb ó Bi.
El Ni y Co presentan un comportamiento semejante. El mineral que va a aparecer en condiciones endógenas es la Pentladita, siendo el único que se encuentra en relación con los yacimientos de segregación magmática. En España, en relación con estos yacimientos de segregación magmática, se encuentra la Niquelina asociada a la Cromita, la paragénesis es Niquelina-Cromita.
El Ni2+ es aproximadamente al Mg, con un radio igual a 0.78Å, pudiendo por tanto estar el Ni sustituido por Mg cuando cristalizan Olivinos.
El Ni3+ y Ni4+ van a formar compuestos en la fase hidrotermal, como arseniuros de Ni, que se encuentran asociados en distritos de metales Ni-Co-Bi-Ag-U.
El Co se presenta en forma oxidada (+2 y +3). Su radio es parecido al del Fe, y es frecuente que en mayor o menor proporción se sustituya en la Pirita. El Co y sus compuestos, asociados a Pirrotina, Pirita y Calcopirita, fundamentalmente se va a formar en las etapas hidrotermales, no dándose en los primeros estadios de la segregación magmática.
El Ni y el Co se pueden formar en determinadas cuencas. El Ni y el Co en el mar se encuentran en menor proporción, pero si se dan condiciones reductoras pueden originarse sulfuros.
- B.1.b.1 Subgrupo dentro del grupo Ni-Co-Fe:
Se encuentran una serie de sulfuros y arseniuros de los que se describirán 4:
| Mineral | Fórmula | Sistema | Densidad | Dureza |
|---|---|---|---|---|
| Pentladita | (Fe,Ni)9S8 | Cúbica | 4.5 | 4.0 |
| Niquelina | AsNi | Hexagonal | 7.8 | 5.0 |
| Pirrotina | SFe1-x | Hexagonal | 4.7 | 4.0 |
| Millerita | SNi | Trigonal | 5.4 | 3.0 |
PENTLADITA: Es un mineral que se utiliza como mena de Ni, y contiene Fe y Ni. Normalmente la relación Fe:Ni es 1:1, aunque existen variedades que poseen un pequeño porcentaje de Co.
La Pentladita suele aparecer en rocas ígneas básicas, donde puede estar asociada a otros minerales de Ni, a Calcopirita y a Pirrotina, en esta última como inclusiones de Pentladita. Se distingue de la Pirrotina porque no es magnética y su partición octaédrica.
Es cúbica y rara vez se presenta en forma de cristales, más frecuente resulta en agregados granulares. Es de color amarillo bronce, con raya negra-verdosa. Se exfolia según {111}.
Su estructura es complicada. Es una estructura cúbica centrada en las caras, bastante compleja, con los átomos metálicos en coordinación octaédrica y tetraédrica con el S. Los tetraedros se encuentran unidos por las aristas y los vértices.
Aparece en condiciones de alta temperatura, en yacimientos de segregación magmática en los primeros estadios de la cristalización, y como se ha dicho antes, asociada a Pirrotina y Pirita. Existen yacimientos en España en la Serranía de Ronda. Pero el yacimiento más importante es el de Subbury, Ontario, donde junto con la Pirrotina constituye la mena principal del Ni.
NIQUELINA: En condiciones teóricas contiene un 44% de Ni y un 56% de As. Normalmente con un poco de Fe, Co y S. El As con frecuencia se encuentra reemplazado en parte por el Sb.
Raramente aparecen cristales tabulares, siendo más frecuente masivo, reniforme con estructura columnar. La estructura del NiAs está basada en un empaquetado hexagonal compacto de átomos de As que dan una secuencia ABABAB..... Los átomos de Ni se encuentran en coordinación 6 con los de As, existiendo huecos de coordinación 4.
Posee brillo metálico, color rojo de Cu pálido con tonalidades que van del gris al negruzco. Su raya es pardo-negra.
Suele parecer asociada a:
· Cromita-Niquelina en Ronda.| ┌Ni-Co-Bi-Ag-U En Hergebirge (Hz) | |
| · Hidrotermales | │ |
| └ Ni-Co-Fe (Típico en la zona de Ontario) |
PIRROTINA: La mayor parte de las Pirrotinas poseen una composición variable, pero tienen siempre deficiencia de Fe, tal como se ve en su fórmula Fe1-xS; donde x, puede variar de 0 a 0.2. Esto es debido a una solución sólida por omisión, en este caso, el S está en un empaquetado hexagonal compacto y el Fe se encuentra en coordinación 6 con el S. En las Pirrotinas existe una variación en el % de vacancias en las posiciones octaédricas, haciendo que la posición varie desde el Fe6S7, hasta el Fe11S12, cercana al FeS.
Los minerales que como en la Pirrotina, una posición estructural está incompletamente llena, se conocen como estructuras defectuosas. Cuando el Fe2+ está ausente de algunas posiciones octaédricas de la Pirrotina, con el S neto completamente intacto, la estructura no es eléctricamente neutra. Es posible que parte del Fe se encuentre en estado Fe3+ para compensar la deficiencia del Fe2+. Estas sustituciones hacen que la densidad de la Pirrotina sea variable.
Es de color bronce pardo, raya negra, y su principal cualidad es que es magnética, en menor medida cuanto mayor es el contenido en Fe. Es monoclínica por debajo de los 250°C y hexagonal por encima de los 300°C. Los cristales suelen ser normalmente tabulares, en algunos casos tabulares indicando la formación el polimorfo de alta temperatura.
Aparece asociada a Pentladita, por tanto se forma en relación con los yacimientos endógenos de alta temperatura. Pero es un sulfuro que aunque aparece asociado a yacimientos de segregación magmática tipo Subbury de inmiscibilidad líquida, aparece también asociado a condiciones de alta temperatura en Skarn Sn-W, como en skarn Fe-Cu. También se encuentra en yacimientos hidrotermales de alta temperatura en relación con los filones cuarzo-auríferos, en el distrito de Morro Velho.
En el caso de la Pirrotina se ha llegado a sintetizar un mineral artificial que no se encuentra en la naturaleza llamado Smithtita.
MILLERITA: Su fórmula empírica es NiS, con un 65% de Ni y un 35% de S. Es raro que aparezca en forma de arseniuros. Puede contener también pequeñas cantidades de Cu y Fe. El polimorfo de baja temperatura cristaliza en el sistema hexagonal.
Su estructura es compleja ya que es uno de los pocos minerales en los que la coordinación es 5, tanto del Ni como del S. Cuando aparece cristalizada, a diferencia de la Niquelina, da agregados aciculares y a veces radiales.
Presenta un polimorfo de alta temperatura, que posee una estructura tipo Niquelina (NiAs), teniendo una importante deficiencia metálica, Ni1-xS, similar a la Pirrotina.
La paragénesis es la misma que la Niquelina.
La Pirita es un sulfuro muy frecuente, como accesorio en casi todas la mineralizaciones.
En el grupo de la Pirita aparecen compuestos en los que el anión es S2- o bien el Se2-. Pero además puede existir sustitución de un As por un Sb, obteniéndose así dos subgrupos:
| Py -------- | S2Fe | |||
| a) | Py ---- | Bravoita -- | S2(Fe,Ni)9 | |
| Vaesita --- | SNi | ¦fig. 101. | ||
| Cobaltita -- | CoAsS | |||
| b) | Cobaltita ---- | Gerdorfita - | Ni | |
| Ulmanita --- | NiSbS |
a) PIRITA: La Py es sulfuro que contiene un 46.6% de Fe y un 53.4% de S. De la Py se obtiene industrialmente el H2SO4.
Se encuentra asociada a otros elementos importantes como el Zn (Esfalerita), Pb (Galena) y Cu sobre todo.
Además de Fe, en su composición puede haber también en trazas Ni, Co ó As, también Au, Ag y Cu.
Su estructura es tipo NaCl, cúbica, modificada con el Fe ocupando el lugar del Na y los grupos S2 ocupando la posición del Cl. Entonces el Fe se encontraría ocupando las posiciones centrales de las caras y el S en la mitad de las aristas y centro del cubo. La distancia S-S es ligeramente inferior a la suma de los radios S-S, esto implica que debe existir una participación de enlace covalente.
Presenta buenos cristales, en forma cúbica, cuyas caras están normalmente rayadas con estrías, perpendiculares entre sí en caras adyacentes; el piritoedro y el octaedro. El piritoedro se encontraría a temperatura media.
Su raya es verdosa o pardo-negra, La dureza es alta de 6 a 6.5, raro en un sulfuro. Su densidad es de 5, no exfolia, su color es amarillo. El parámetro de celdilla aumenta con el contenido en Fe.
La Py es el sulfuro más corriente y extendido. Se forma tanto a altas como a bajas temperaturas, pero las mayores masas son con probabilidad de alta temperatura.
La Py se explota en menas piríticas (en francés amas sulfuradas o sulfuros complejos). En España existe una provincia metalogénica muy importante en Aznadcollar (muy conocido recientemente por el desastre ecológico) y Ajustel. Estos sulfuros complejos son de tipo vulcano-sedimentario, y a él pertenecen los yacimientos de Riotinto, La Zarza, Las Herrerías y Sotiel. Dentro de esta provincia existe toda una serie de variaciones en el modelo exhalativo-sedimentario. Estos yacimientos van a tener una morfología lenticular y cuando las masas no están consolidadas se pueden desplazar originando yacimientos alóctonos, o bien alejarse mucho del foco dando un yacimiento sedimentario, cuyos elementos tendrán un naturaleza ígnea, pero el yacimiento será típicamente sedimentario.
De estos yacimientos se recupera Zn, Py, Pb y Cu, y asociado Ag y Au. La disposición en los yacimientos es a techo Pb-Zn y a muro Cu.
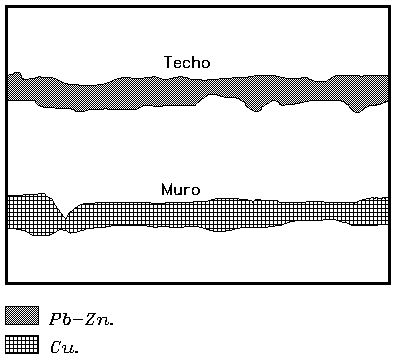
Principalmente se utiliza para suministrar S para la producción de H2SO4 y caparrosa (sulfato ferroso). La caparrosa se emplea en tintes, en la fabricación de tintas, como preservativo de la madera y como desinfectante.
b) COBALTITA: Es un sulfoarseniuro de Co, que en condiciones teóricas posee de un 26% a un 34% de Co, pudiendo contener cantidades importantes de otros elementos como Ni y Fe (en contenidos aproximados al 16% de denominan ferrocobaltinas).
Su estructura es parecida a la de la Py, en la que la mitad de los pares S2 se encuentran reemplazados por el As. Tal sustitución provoca una disminución de la simetría de la estructura de la Cobaltina respecto a la Py. Las Cobaltinas naturales poseen una distribución desordenada de As y S en la estructura.
Su color es blanco Ag, pero por su contenido en Co da tinte rosa. La raya en negra-grisácea.
Aparece en yacimientos hidrotermales de alta temperatura, así como en los metasomáticos de contacto tipo skarn. Cuando se altera da rosetas de vitrina.
© Mario Izquierdo, 2024 | Aviso legal | Política de Privacidad